*Post-evidencias: pruebas científicas de la efectividad y seguridad de los medicamentos en la era del nihilismo médico
iPCSK-9: NUEVOS FÁRMACOS PARA TRATAR EL COLESTEROL ¿UNA NUEVA ERA EN RIESGO CARDIOVASCULAR?
Los anticuerpos monoclonales inhibidores de la enzima pro-proteína convertasa subtilisina/kexina tipo 9 (en adelante iPCSK-9) son unos nuevos fármacos para bajar el colesterol plasmático. Los anticuerpos monoclonales son un subtipo de inmunoterapia. La inmunoterapia habitualmente se usa en oncología, pero se está aplicando a muchas áreas de la biomedicina: enfermedad cardiovascular (iPCSK-9), osteoporosis (denosumab), artritis reumatoide, psoriasis, etc. Sus resultados clínicos, en general, son modestos, y tienen un precio elevado.
Los iPCSK-9 son medicamentos de dispensación hospitalaria en España. La Agencia Europea del Medicamento aprobó el uso de alirocumab, el primer iPCSK-9, en mayo de 2015, y poco después dio también el visto bueno la Agencia Española del Medicamento. En el año 2018 ha sido aprobado evolocumab. Actúan inhibiendo la degradación del receptor LDL en la superficie del hepatocito, aumentado el aclaramiento de LDL-c y disminuyendo el colesterol-LDL plasmático.
A pesar de ser medicamentos que, por ahora, no se van usar en la Atención Primaria, mi ámbito de trabajo, y no los van usar la mayoría que lean esta entrada, los voy a utilizar como ejemplo del grado de evidencia o pruebas necesario para que la biomedicina implemente una intervención. En muchas entradas de NoGracias ya se ha evidenciado que la biomedicina tiene un grave problema con la calidad de la investigación primaria, con un porcentaje imposible de estudios con resultados positivos (95%), un elevado porcentaje de revocaciones (40%), etc. Una de las soluciones propuestas para mejorar la situación es hacer mejores estudios.
Tenemos que dejar de aceptar, salvo casos de extrema urgencia, estudios sesgados para implementar una intervención. Pero no aprendemos de nuestros errores. Una y otra vez se aprueba la utilización de fármacos con un solo estudio pivotal clínico con sesgos. Además, en este estos fármacos también sirven como ejemplo del uso de las revisiones sistemáticas y los meta-análisis para blanquear las pruebas científicas disponibles; y lo siento pero una revisión sistemática compuesta de estudios sin potencia estadística o sesgados será una revisión sistemática sesgada y problemática, por muy bien hecha que esté. En general, el problema de la investigación en medicina clínica son los estudios primarios de mala calidad, y eso no se arregla con un meta-análisis, se arregla con mejores estudios primarios
iPCSK-9: LA EVIDENCIA
Una revisión sistemática de la Cochrane del año 2017[1] encontró 20 ensayos clínicos con iPCSK-9. De los 20 ensayos clínicos, 13 los comparaban con placebo, 2 con ezetimiba y 5 con ezetimiba+estatinas. Y de estos 20, sólo 8 tenían como medida de resultado la incidencia de enfermedad cardiovascular; los 12 restantes sólo estudiaban si estos fármacos bajaban los niveles de colesterol. Recordemos que los ensayos clínicos con medidas de resultado subrogadas no sirven para demostrar la eficacia de una intervención. La eficacia tiene que demostrarse sobre medidas de resultado duras (enfermedad, muerte), sobre todo si el tratamiento es preventivo.
A esta revisión habría que añadir un nuevo estudio publicado el en New England Journal of Medicine el 7 de noviembre del año 2018[2], que compara alirocumab con placebo en relación a morbimortalidad cardiovascular en pacientes que han tenido un síndrome coronario agudo. Tenemos entonces en total 9 estudios con medidas de resultado duras; comentaré los más importantes.
De los estudios incluidos en la revisión, sólo hay que tener en cuenta 3, ya que el resto son estudios pequeños, con el intervalo de confianza abarcando el 1 y, por lo tanto, no son estadísticamente significativos. Agregar estudios pequeños en una revisión sistemática o meta-análisis no soluciona el problema de falta de potencia estadística ni disminuye el riesgo de falso positivo. Al contrario, perpetúa el problema y además parece blanquear los sesgos de los estudios primarios defectuosos. Una revisión sistemática de estudios primarios problemáticos será, ineludiblemente, una revisión sistemática problemática. La probabilidad de equivocarnos al agregar estudios pequeños sin potencia estadística es elevada[3].
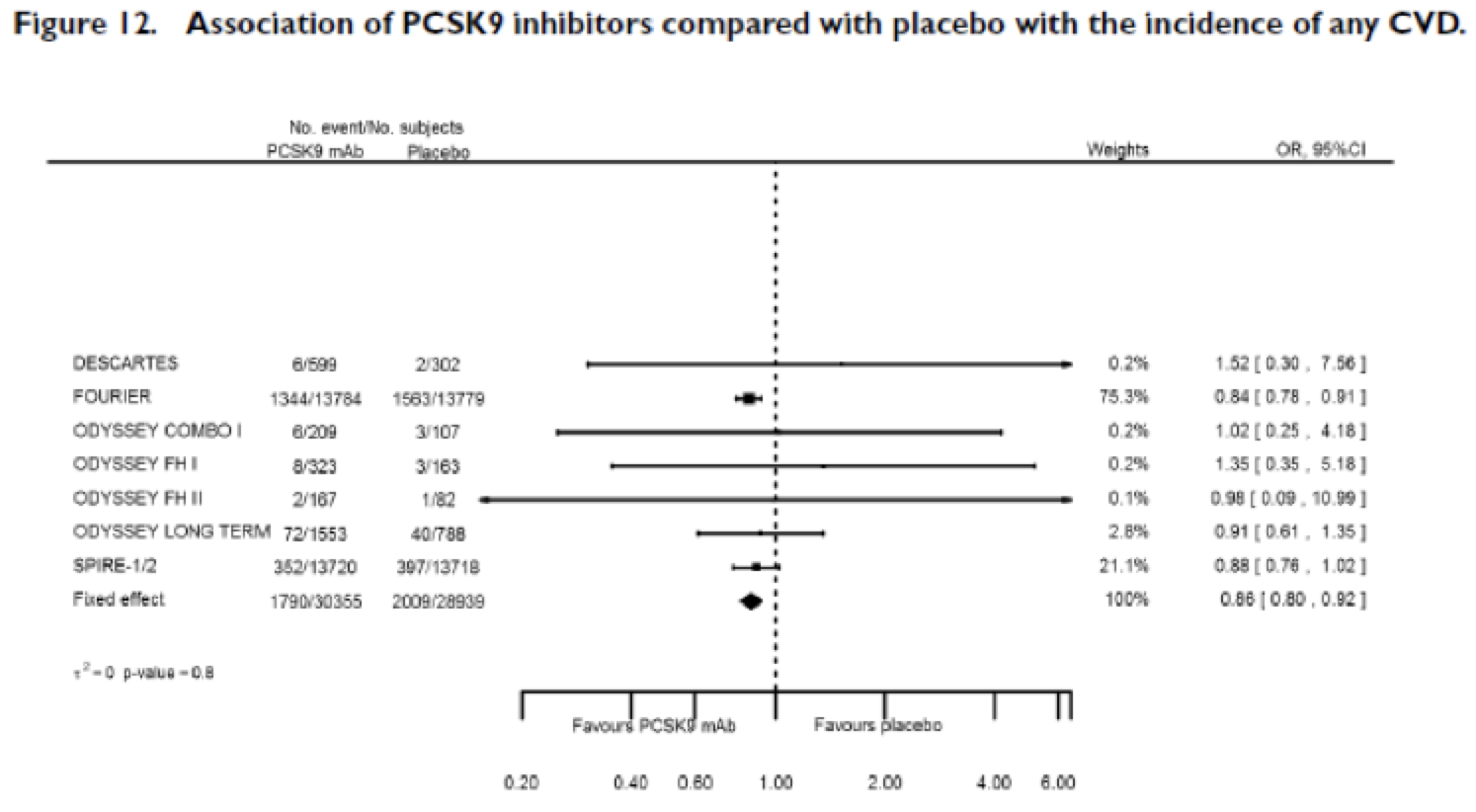
Los ensayos a considerar de la revisión son: FOURIER, SPIRE-1/2 y ODISSEY LONG TERM, a lo que añadiré el ensayo publicado hace pocos meses en el NEJM, ODISSEY OUTCOMES.
Como cosa a reseñar de la revisión hay que decir que considera a todos los estudios incluidos con alto riesgo de sesgo. ¿Por qué? Por estar financiados todos por la industria. La Cochrane considera que el simple hecho de estar financiado por la industria confiere a los estudios tengan un riesgo de sesgo elevado.
Una revisión de la Cochrane del 2017[4] (que en realidad es una actualización de otra más antigua) ya mostró que los estudios financiados por la industria tienen más probabilidades de mostrar que la intervención es más eficaz (RR 1’27) y conclusiones más favorables (RR 1’34). Este sesgo no se puede detectar con el análisis y las herramientas habituales. Es una categoría en si mismo, al igual que la falta de enmascaramiento o la falta de aleatorización. El ensayo ODISSEY OUTCOMES, no incluido en la revisión por ser posterior, también tiene un riesgo de sesgo alto, pues está financiado por la industria.
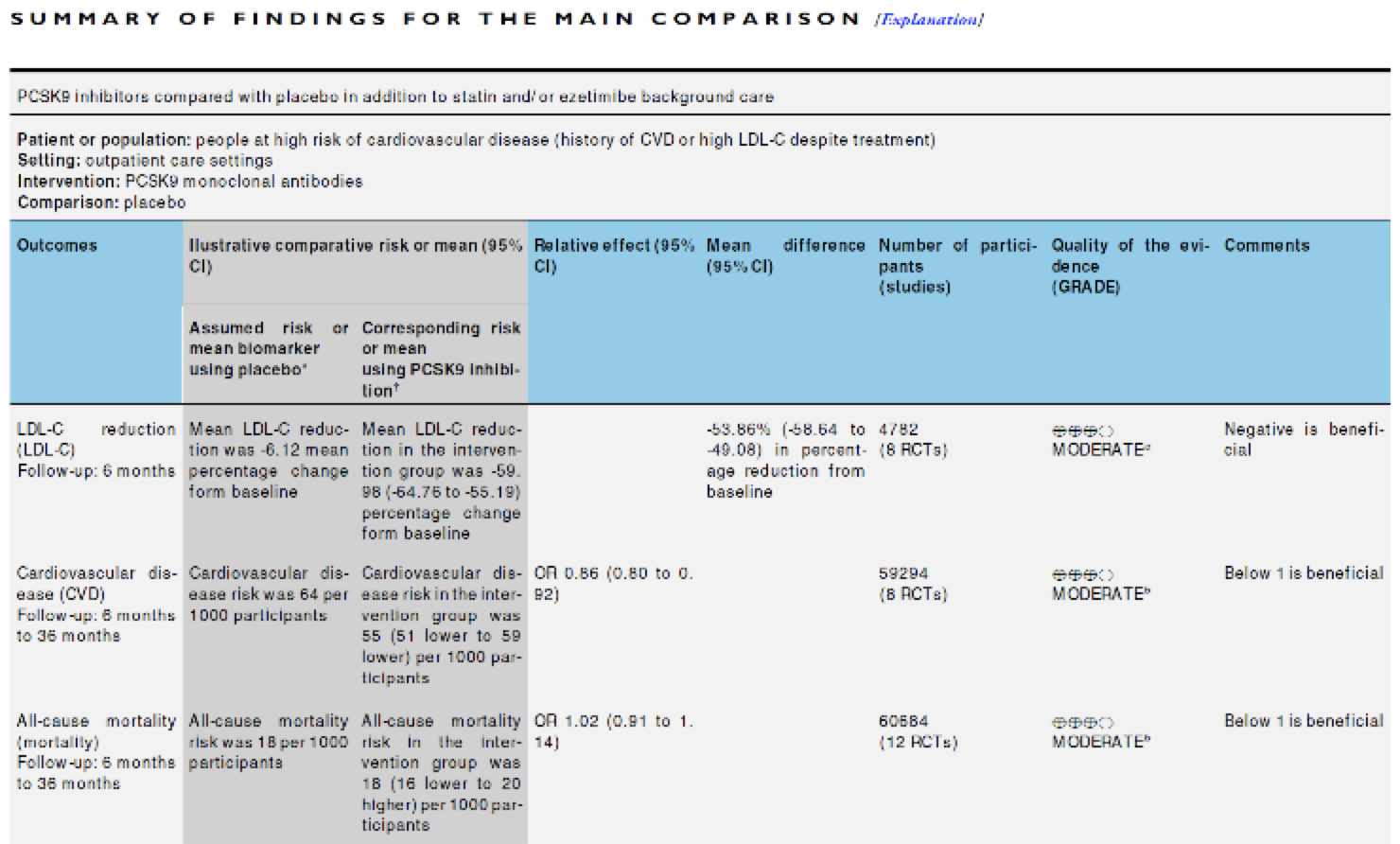
La revisión sistemática muestra que los iPCSK-9 disminuyen de manera modesta la incidencia de enfermedad cardiovascular, pero sin afectar la mortalidad cardiovascular ni la total.
(1) Ensayo ODISSEY LONG TERM[5]:

En un análisis post hoc, o sea, en un análisis que no estaba especificado antes de ver los datos finales, se encuentra una reducción del 48% del riesgo de eventos cardiovasculares. La incidencia de enfermedad cardiovascular no estaba incluida en el protocolo colgado en clinicaltrials.gov como medida de resultado. Lo siento, pero un análisis post hoc (aka p-hacking) no sirve para demostrar ninguna hipótesis. Sirve para plantear una nueva hipótesis que tiene que ser demostrada con otro estudio. Así que, a pesar de que los revisores incluyan este ensayo clínico, yo creo que habría que descartarlo. No estaba diseñado para estudiar la incidencia de enfermedad CV y el riesgo de un falso positivo podría ser muy elevado.
Sólo con este estudio tuvieron suficiente la FDA y la EMA para aprobar la comercialización de alirocumab.
¡Un solo estudio con medidas de resultados subrogadas o intermedias (baja el colesterol), y con efecto sobre medidades de resultados duras (enfermedad CV) demostradas en un análisis post hoc!
(2) Ensayo SPIRE[6]

El ensayo clínico SPIRE finaliza precozmente; estaba pensado para durar de 3 a 4 años y al año lo acaban. ¿Por qué? Porque el fármaco no es eficaz y la mayoría de pacientes desarrollan anticuerpos contra el fármaco. Aún así, los autores hacen un subanálisis y dicen que el medicamento es beneficioso en pacientes de alto riesgo.

El estudio se publica en el NEJM seis meses después de que Pfizer anunciase que suspendía el desarrollo de bococizumab y los ensayos SPIRE 1 y 2. El motivo era el comentado antes: se desarrollan anticuerpos con el fármaco, deja de ser eficaz con el tiempo. Aunque, Pfizer dice que puede ser beneficioso en pacientes de alto riesgo, a pesar de haber suspendido el desarrollo del fármaco por ineficaz. Pero lo peor es que los autores incluyen el estudio en la revisión Cochrane, con un resultado que, aunque roza la significación estadística, tiende a favorecer a los iPCSK-9.
¿Por qué incluir un fármaco cuyo ensayo clínico pivotal se ha suspendido por ineficaz? ¿Por qué incluirlo además, con un resultado que tiende a ser positivo?
El ensayo SPIRE se suspende porque el fármaco no es eficaz, pero se incluye en la revisión sistemática favoreciendo los iPCSK-9. El fracaso de bococizumab, que tendría que cuestionar la eficacia de este tipo de medicamentos, puede sin embargo hacer lo contrario: favorecer a otros fármacos de su clase después de haberse suspendido su desarrollo y no llegar a comercializarse. Se publica en el NEJM con conclusiones favorables y los autores de la revisión Cochrane lo incluyen con resultado más bien positivo en la revisión.
En modo irónico: bocicizumab, después de muerto, vuelve del más allá para ayudar a sus compañeros, alirocumab y evolocumab. Me recuerda a la película “Ghost”. Yo no hubiera incluido el estudio en la revisión por razones obvias. Y si se incluye, de ninguna manera el resultado puede ser positivo.
(3) Ensayo FOURIER[7]:
El ensayo clínico FOURIER es, claramente, el más importante de los incluídos en la revisión, y el que tiene mayor peso en las conclusiones.

El outcome primario es combinado, o sea, combina varias medidas de resultado. A mi no me gustan las medida de resultado combinadas porque muy a menudo confunden: obtienen resultados positivos actuando sólo sobre las medidas menos importantes. Y no es lo mismo bajar la mortalidad que las tasas de hospitalización; de hecho, se puede subir la mortalidad bajando las tasas de hospitalización.
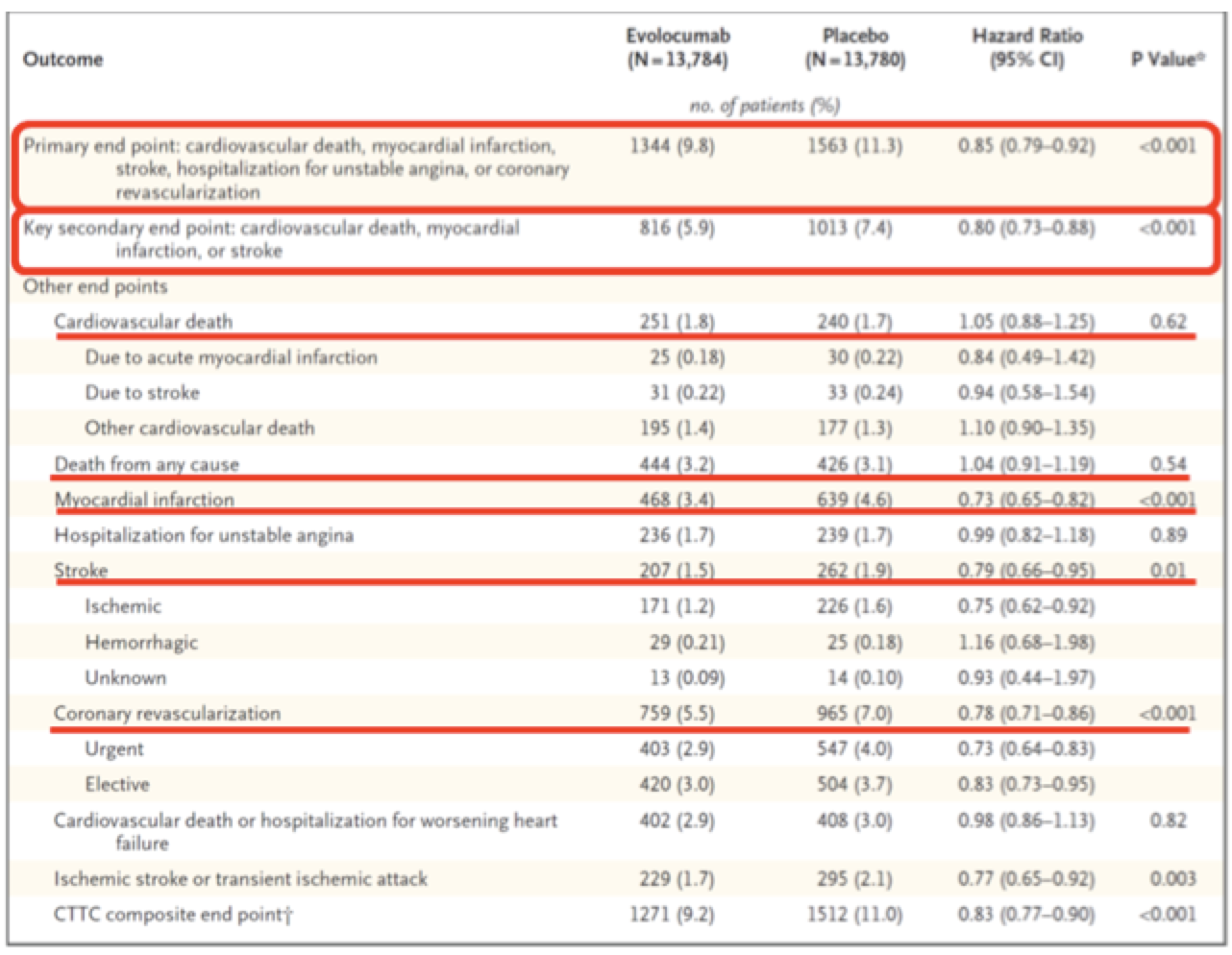
Esta es la tabla con los resultados del estudio. He marcado con rojo los resultados más importantes. Como vemos, el resultado es positivo para el outcome primario y el secundario principal, ambos outcomes combinados. Al fijarnos en las medidas de resultado por separado, vemos que también se disminuye el riesgo de infarto e ictus. Sin embargo no se disminuye el riesgo de muerte por infarto e ictus ni la mortalidad total. De hecho, parece que se tiendan a morir más personas con evolocumab que con placebo, pero sin llegar a la significación estadística. Curioso.
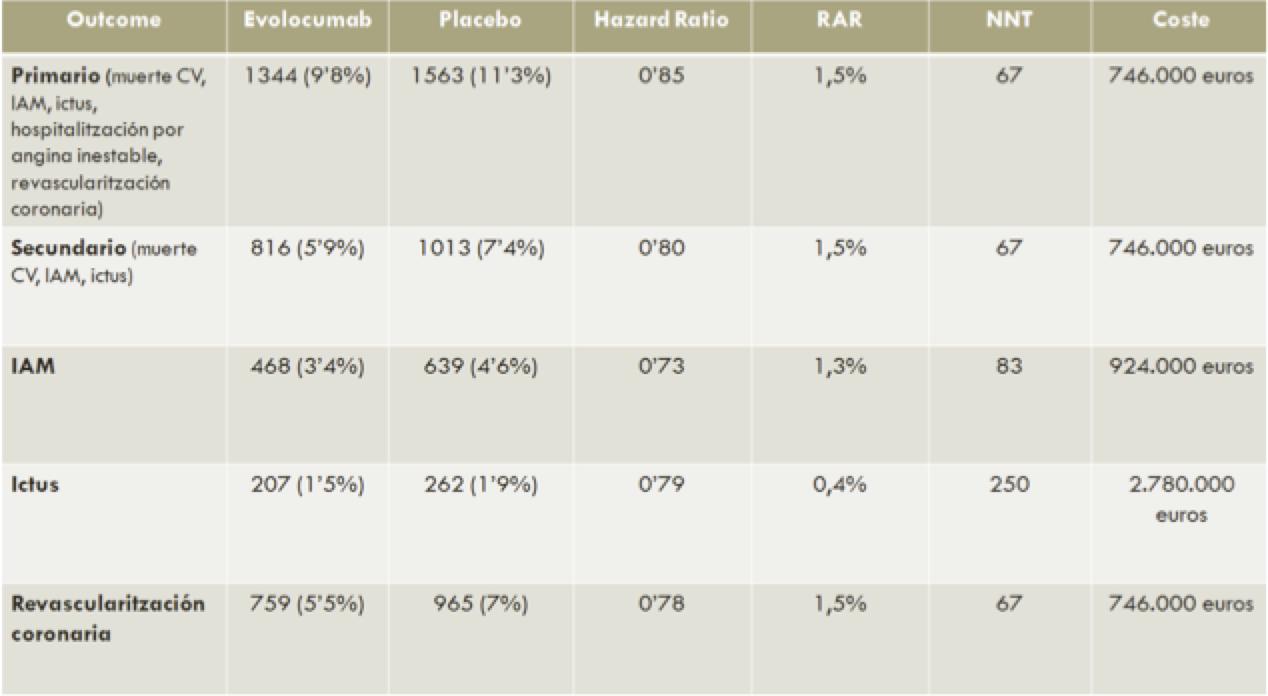
Aquí tenemos una tabla con los resultados positivos más claros. En la tabla se puede observar la reducción absoluta de riesgo, que es preferible a la relativa, el número de personas necesario a tratar (NNT) para prevenir un evento y el coste aproximado que tiene reducir este evento. El coste promedio de tratar un paciente con evolocumab durante 26 meses en el estudio FOURIER fue de 11.134,78 euros[8]. Sólo hay que multiplicar esta cifra por el NNT y ya tenemos los que cuesta prevenir un evento. El precio es elevadísimo. Prevenir un ictus cuesta casi 3 millones de euros.
¿Cuáles son los principales problemas que pueden sesgar el estudio o dificultar la interpretación de sus resultados?
- Financiado por el fabricante del fármaco (Amgen)
- Muestra muy seleccionada que resta validez externa
- El comparador es placebo (no es correcto cuando existe ya un tratamiento eficaz para el trastorno o factor de riesgo)
- Medida de resultado combinada, con efecto sólo sobre la morbilidad (infarto, ictus), sin afectar la mortalidad CV ni la total. De hecho, parece que ambas medidas de mortalidad tienden a aumentar, sin llegar a la significación estadística, en el grupo de evolocumab. Esto crea suspicacias, ya que un aumento de la mortalidad podría sesgar el estudio, bajando las tasas de revascularización, los infartos y los ictus en el grupo de evolocumab no porque el fármaco sea mejor, sino porque muere más gente (p.e. se ingresan menos pacientes porque se mueren más)
- Finalización precoz: estaba diseñado para durar 36 meses, pero se detiene a los 26. Esto exagera el resultado del estudio
Por todos estos problemas, el estudio FOURIER tiene un riesgo de sesgo elevado, como así reconocen los autores de la revisión Cochrane. Pero al incluirlo en la revisión pareciera que los sesgos y los problemas se lavan y desaparecen. Pero no, siguen estando ahí, e igual van a sesgar la revisión.
¿La solución a los sesgos de los estudios primarios es hacer revisiones sistemáticas impecables? Pues, no
(4) Ensayo ODISSEY OUTCOMES[2]:
Y llegamos al último ensayo clínico, publicado en noviembre de 2018 en The New England Journal of Medicine. La financiación corre a cargo de Sanofi y Regeneron Pharmaceuticals, por lo tanto, sólo por este detalle, el riesgo de sesgo es elevado. Pero es que además, los espónsor participan en la elección de los lugares donde se desarrolla el ensayo clínico, en la monitorización del estudio, supervisan la recolección de datos y analizan los datos en paralelo con el estadístico del estudio. Esto es mucho más que sólo financiar.

Como es habitual, la muestra es muy seleccionada y habrá problemas para extrapolar los resultados. El ensayo tiene un claro sesgo de género, el 75% de la muestra son hombres. Además, tenemos otro outcome primario combinado y problemático; mezcla mortalidad con morbilidad y con ingresos. Habrá que evaluar con cuidado sobre qué medida de resultado tiene efecto[9]. Los ingresos no son una medida de resultado confiable, ya que hasta en 1/3 de los estudios podemos disminuir los ingresos y aumentar la mortalidad[10] .
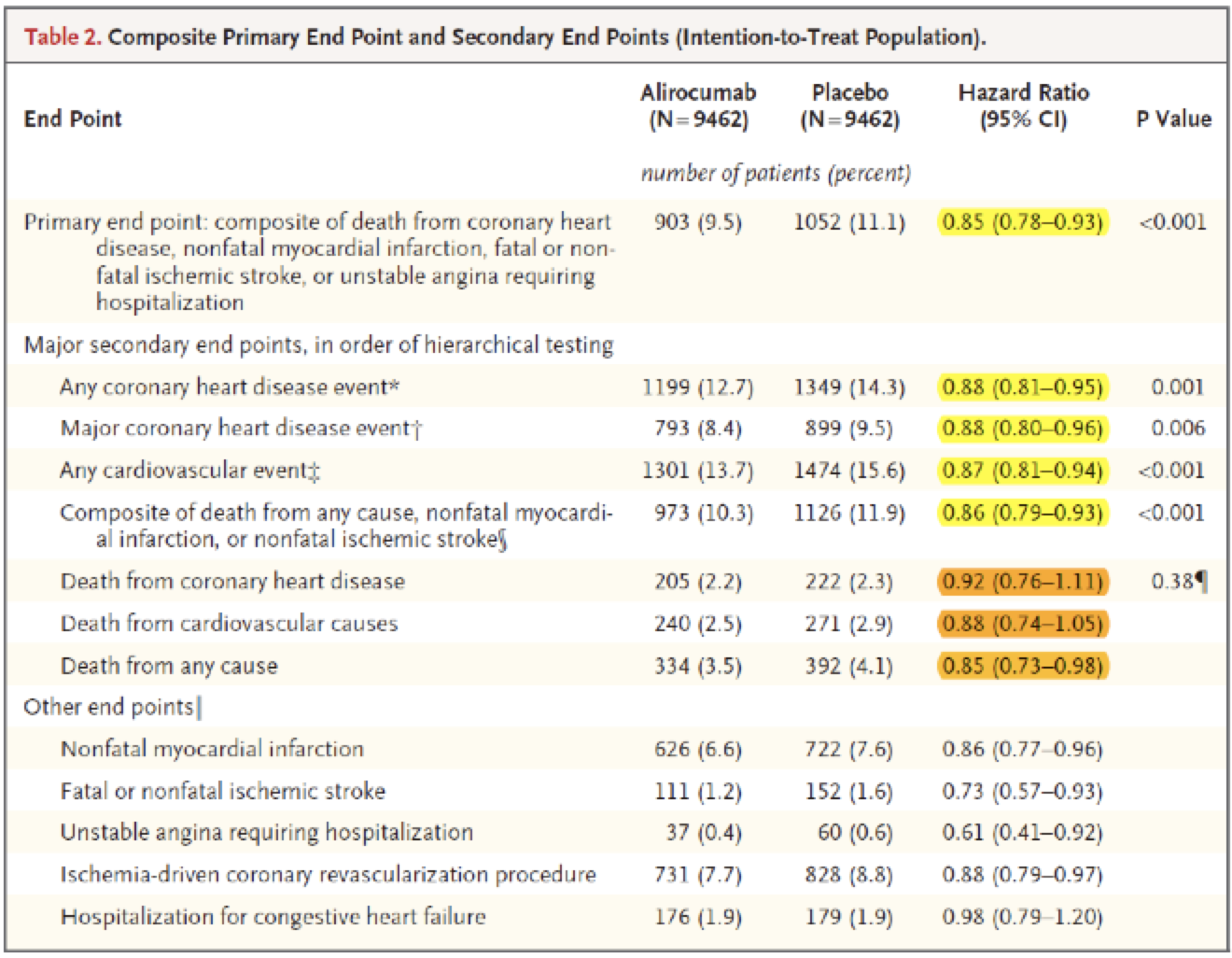
Estos son los resultados del estudio. Los resultados positivos están resaltados en amarillo y los negativos en naranja. Podemos observar que, en general, alirocumab baja aproximadamente un 15% el riesgo de morbilidad cardiovascular (entre 1 y 2% en términos absolutos), y se observa una tendencia a bajar la mortalidad cardiovascular y total sin llegar a la significación estadística. Aquí, a diferencia del ensayo FOURIER, los resultados sobre mortalidad son congruentes con los de morbilidad.
¿Cuáles son los principales problemas que pueden sesgar el estudio o dificultar la interpretación de sus resultados? (parece una copia del FOURIER)
- Financiado por el fabricante del fármaco (Sanofi y Regeneron Pharmaceuticals)
- Muestra muy seleccionada que resta validez externa, 75% hombres
- El comparador es placebo (no es correcto cuando existe ya un tratamiento eficaz para el trastorno o factor de riesgo). Tendría que compararse con el fármaco de referencia (estatina)
- Medida de resultado combinada, con efecto sólo sobre la morbilidad, sin afectar significativamente la mortalidad CV ni la total
- Finalización precoz: estaba diseñado para durar 5 años y 4 meses, pero se detiene a los 2 años y 10 meses. Esto, es bien sabido, exagera el resultado de la intervención.
- Periodo de entrada: 2 a 16 semanas. Durante este tiempo, además de ver si toleran la estatina, se enseña a los participantes a administrarse placebo mediante inyección subcutanea. Esto se efectúa antes de la aleatorización de la muestra. Al inicio, entran en el cribado 35.437 personas, de las cuales entran y se aleatorizan 18.924. Se pierden 16.505 personas, la mayoría por fallo en el cribado. De estas, ¿cuántas son por no tolerar o no saber administrarse la inyección subcutánea? Ni en el estudio publicado ni el la información suplementaria se especifica esta información. Al parecer ninguno, pero alguno tiene que haber tenido este problema entre casi 36.000 personas. Eliminar a los intolerantes también magnifica el resultado de la intervención. No hay que creer que esto es algo menor. Al ser el efecto de la intervención pequeño, eliminar unos pocos pacientes con resultado negativo puede convertir un resultado en estadísticamente significativo.
Por todos estos problemas y sesgos, el ensayo ODISSEY OUTCOMES, al igual que el estudio FOURIER, tiene un riesgo elevado de ser un falso positivo.
La consideración del precio viene después de la eficacia, la cual, como he comentado, es cuestionable. Aún así, comentaré que el precio es muy elevado. Un estudio de coste-efectividad realizado en EEUU, calcula que para que el fármaco sea coste-efectivo, el precio tiene que reducirse casi un 87%, de 14.560 a 1974 dólares[11].
iPCSK-9: CONCLUSIÓN
- La biomedicina no tiene porque implementar un tratamiento cuyos 2 estudios pivotales tienen serios problemas.
- Hay que recordar que el tratamiento es preventivo (prevención secundaria), no es para mejorar ningún síntoma.
- A pesar de que disponemos de un tratamiento efectivo (estatinas), los estudios los comparan con placebo.
- El precio, elevadísimo, no se tendría ni que mentar, ya que el problema principal es la eficacia.
¿iPCSK-9?… todavía no, gracias.
Sebastián Vignoli Carradori en médico de familia y miembro de la Junta Directiva de NoGracias
BIBLIOGRAFÍA
[1] A. F. Schmidt, L. S. Pearce, J. T. Wilkins, J. P. Overington, A. D. Hingorani, and J. P. Casas, “PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease,” Cochrane Database Syst. Rev., Apr. 2017.
[2] G. G. Schwartz et al., “Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome,” N. Engl. J. Med., p. NEJMoa1801174, Nov. 2018.
[3] J. LeLorier, G. Grégoire, A. Benhaddad, J. Lapierre, and F. Derderian, “Discrepancies between meta-analyses and subsequent large randomized, controlled trials.,” N. Engl. J. Med., vol. 337, no. 8, pp. 536–42, Aug. 1997.
[4] B. L. Lundh A, “Industry sponsorship and research outcome,” Cochrane Database Syst. Rev.
[5] J. G. Robinson et al., “Efficacy and Safety of Alirocumab in Reducing Lipids and Cardiovascular Events,” N. Engl. J. Med., vol. 372, no. 16, pp. 1489–1499, Apr. 2015.
[6] P. M. Ridker et al., “Cardiovascular Efficacy and Safety of Bococizumab in High-Risk Patients,” N. Engl. J. Med., 2017.
[7] M. S. Sabatine et al., “Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease.,” N. Engl. J. Med., 2017.
[8] A. Olry de Labry Lima, V. Gimeno Ballester, J. F. Sierra Sánchez, A. Matas Hoces, J. González-Outón, and E. J. Alegre del Rey, “Coste-efectividad e impacto presupuestario del tratamiento con evolocumab frente a estatinas y ezetimiba para la hipercolesterolemia en España,” Rev. Española Cardiol., vol. 71, no. 12, pp. 1027–1035, Dec. 2018.
[9] I. Ferreira-González et al., “Problems with use of composite end points in cardiovascular trials: Systematic review of randomised controlled trials,” Br. Med. J., 2007.
[10] L. G. Hemkens, D. G. Contopoulos-Ioannidis, and J. P. A. Ioannidis, “Concordance of effects of medical interventions on hospital admission and readmission rates with effects on mortality.,” CMAJ, vol. 185, no. 18, pp. E827-37, Dec. 2013.
[11] D. S. Kazi, J. Penko, P. G. Coxson, D. Guzman, P. C. Wei, and K. Bibbins-Domingo, “Cost-Effectiveness of Alirocumab,” Ann. Intern. Med., vol. 170, no. 4, p. 221, Feb. 2019
[1] A. F. Schmidt, L. S. Pearce, J. T. Wilkins, J. P. Overington, A. D. Hingorani, and J. P. Casas, “PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease,” Cochrane Database Syst. Rev., Apr. 2017.
[2] G. G. Schwartz et al., “Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome,” N. Engl. J. Med., p. NEJMoa1801174, Nov. 2018.
[3] J. LeLorier, G. Grégoire, A. Benhaddad, J. Lapierre, and F. Derderian, “Discrepancies between meta-analyses and subsequent large randomized, controlled trials.,” N. Engl. J. Med., vol. 337, no. 8, pp. 536–42, Aug. 1997.
[4] B. L. Lundh A, “Industry sponsorship and research outcome,” Cochrane Database Syst. Rev.
[5] J. G. Robinson et al., “Efficacy and Safety of Alirocumab in Reducing Lipids and Cardiovascular Events,” N. Engl. J. Med., vol. 372, no. 16, pp. 1489–1499, Apr. 2015.
[6] P. M. Ridker et al., “Cardiovascular Efficacy and Safety of Bococizumab in High-Risk Patients,” N. Engl. J. Med., 2017.
[7] M. S. Sabatine et al., “Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease.,” N. Engl. J. Med., 2017.
[8] A. Olry de Labry Lima, V. Gimeno Ballester, J. F. Sierra Sánchez, A. Matas Hoces, J. González-Outón, and E. J. Alegre del Rey, “Coste-efectividad e impacto presupuestario del tratamiento con evolocumab frente a estatinas y ezetimiba para la hipercolesterolemia en España,” Rev. Española Cardiol., vol. 71, no. 12, pp. 1027–1035, Dec. 2018.
[9] I. Ferreira-González et al., “Problems with use of composite end points in cardiovascular trials: Systematic review of randomised controlled trials,” Br. Med. J., 2007.
[10] L. G. Hemkens, D. G. Contopoulos-Ioannidis, and J. P. A. Ioannidis, “Concordance of effects of medical interventions on hospital admission and readmission rates with effects on mortality.,” CMAJ, vol. 185, no. 18, pp. E827-37, Dec. 2013.
[11] D. S. Kazi, J. Penko, P. G. Coxson, D. Guzman, P. C. Wei, and K. Bibbins-Domingo, “Cost-Effectiveness of Alirocumab,” Ann. Intern. Med., vol. 170, no. 4, p. 221, Feb. 2019.