A finales de 2016, en el Boletin Farmacoterapéutico de Navarra (bitN) Juan Erviti publicó un texto que tituló «Incertidumbres sobre los nuevos anticoagulantes orales en fibrilación auricular: Irregularidades y lagunas en su autorización» donde sintetizaba los problemas detectados en los ensayos clínicos pivotales de la práctica totalidad de los nuevos anticoagulantes.
Sus conclusiones son las obvias:
«Los ensayos clínicos pivotales que dieron pie a la comercialización de dabigatrán, rivaroxabán, apixabán y edoxabán en fibrilación auricular cuentan con numerosas irregularidades, incluidas la ocultación y falsificación de datos. No tenemos información fiable de la relación beneficio-riesgo de dabigatrán, rivaroxabán, apixabán y edoxabán frente a warfarina en fibrilación auricular. Las agencias reguladoras han mostrado tener una falta de rigor preocupante al aprobar estos medicamentos, haciendo caso omiso a distintas deficiencias graves en los ensayos pivotales, detectadas por las propias agencias reguladoras, como los casos de falsificación de datos. Las agencias reguladoras deberían hacer públicos los datos completos de los ensayos clínicos para garantizar la transparencia y así ofrecer información veraz. De este modo se podrá facilitar a los pacientes el mejor tratamiento para su enfermedad.»
En la sección dedicada al apixaban (Eliquis), escribía Erviti:
«El apixabán salió al mercado con los datos de un único ensayo pivotal, conocido como ARISTOTLE. Se diseñó como un ensayo de “no inferioridad” y posteriormente se realizó un análisis de superioridad. La conclusión de los autores fue que, en pacientes con fibrilación auricular, el apixabán fue superior a la warfarina en la prevención de ictus o embolismo sistémico, produjo menos sangrado y redujo la mortalidad. En el artículo del profesor Seife antes mencionado se ofrecen ciertos datos sobre las inspecciones al ensayo ARISTOTLE. Inicialmente se hizo una inspección en un centro en China y se detectó que las historias clínicas habían sido manipuladas. Si se hubieran excluido los datos de ese centro (solo ese centro), la significación estadística obtenida para la mortalidad en el ensayo ARISTOTLE habría desaparecido. Los técnicos de la FDA (Office of Scientific Investigation) recomendaron retirar del ensayo a este centro y otros 23 centros chinos igualmente sospechosos. Sin embargo, en todos los análisis se utiliza el full data set sin excluir a los centros fraudulentos»
El artículo al que hace referencia Erviti es el de Charles Seife, matemático, periodista, divulgador científico y profesor de periodismo en la Universidad de Nueva York que en 2015 describía como la FDA incluía en sus evaluaciones trabajos fraudulentos de los que era consciente (sus inspectores habían descrito las irregularidades) y a pesar de ello utilizaba estas evidencias para permitir la comercialización de los fármacos. Así describe Erviti el artículo de Seife:
«En abril de 2015 el profesor Charles Seife publicó un trabajo de investigación sobre las inspecciones de la FDA a ensayos clínicos y sus resultados. Para ello, realizó un estudio transversal sobre los documentos de dominio público fechados entre el 01/01/1998 y el 30/09/2013 en los que se describen las inspecciones de la FDA en centros con constancia de prácticas irregulares objetivas. Se identificaron 57 ensayos clínicos publicados en los que la FDA había encontrado en sus inspecciones uno o más problemas. Las malas prácticas registradas fueron las siguientes: falsificación o envío de información falsa, 22 ensayos (39%); problemas con la notificación de reacciones adversas, 14 ensayos (25%); violaciones del protocolo, 42 ensayos (74%); registro de la información inadecuado o incorrecto, 35 ensayos (61%); fallo en la protección de la seguridad de los pacientes y/o asuntos relacionados con el seguimiento o el consentimiento informado, 30 ensayos (53%) y otras malas prácticas, 20 ensayos (35%). Solo 3 (4%) de las 78 publicaciones de ensayos con importantes violaciones mencionaron las prácticas observadas en las inspecciones. No se registró ningún tipo de corrección en las publicaciones, retractación, expresión de malestar o preocupación, ni ningún otro comentario en los casos en que se hizo referencia a las malas prácticas en la publicación.»
Seife describió en este texto como la FDA había detectado fraude científico en los ensayos clínicos pivotales de dos de los nuevos anticoagulantes, apixaban (Eliquis) y rivaroxaban (Xarelto). Con ambos fármacos la respuesta de la FDA, a pesar de conocer estos datos, fue la misma: aceptación de los ensayos clínicos como válidos y aprobación de los medicamentos para su comercialización.
Se acaba de publicar una «Research Letter» en el JAMA of Internal Medicine donde Craig Garmendia, técnico de la FDA, y colaboradores de la Universidad de Florida, evalúan el impacto de un ensayo clínico pivotal fraudulento como el ARISTOTLE en los meta-análisis subsiguientes.

Recordemos que los resultados del ARISTOTLE, ensayo financiado por Bristol-Myers Squibb y Pfizer, aliados para su desarrollo y comercialización, fue publicado en su momento en el New England y glosado en la misma revista con un elogioso editorial que hablaba de «impressive primary results of the Apixaban». A día de hoy, en el NEJM no existe ninguna «corrección.. retractación, expresión de malestar o preocupación, ni ningún otro comentario … en referencia a las malas prácticas» del ensayo clínico publicado y elogiado en sus «sagradas» páginas.
Pues bien; después del doble blanqueamiento del fraude ARISTOTLE -del NEJM que no ha retractado o realizado comentario alguno al ensayo que publicó y elogió- y de la FDA -que conociendo el fraude lo acepta como evidencia para aprobar su comercialización- se produce un tercer proceso de blanqueamiento a través de la inclusión de dicho ECA en los metaanálisis subsiguientes.
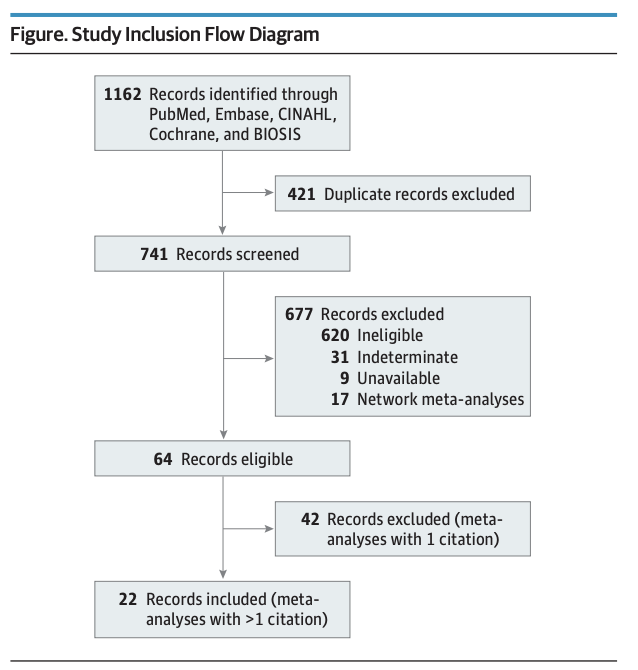
Garmendia y colaboradores analizan qué pasaría con los positivos resultados de los 22 meta-análisis realizados con ECAs del apixaban y publicados entre 2012 y 2017 (mediana de factor impacto de 5.830 con rango entre 3.154 y 17.202), que incluyeron el fraudulento ensayo clínico ARISTOTLE en la evaluación, si éste fuera excluido.
El peso de un ensayo clínico del tamaño del ARISTOTLE, con más de 18.000 pacientes incluidos, en meta-análisis que cuentan con una mediana de publicaciones evaluadas de 9 (rango entre 2 y 28) es lógicamente importante. En efecto, la mediana del peso del ARISTOTLE en los meta-análisis fue de 37.3% (rango 7%-100%).
Los autores re-analizan los 22 meta-análisis excluyendo los resultados del ARISTOTLE encontrando:
«…el 46% de las publicaciones de los meta-análisis tenían conclusiones alteradas por las publicaciones con datos falsificados, y el 32% de todos los análisis mostraban resultados contrarios a las conclusiones a favor del medicamento».
La conclusión de los autores es muy semejante a la de Juan Erviti en su texto del bitN
«Este estudio debería impulsar la realización de análisis de sensibilidad robustos y llevar a cabo acciones de protección más sólidas contra los ensayos con datos falsificados.. que pueden afectar no sólo a la publicación original sino también a cualquier meta-análisis subsiguiente y a las recomendaciones clínicas basadas en los hallazgos de estos estudios.»

El jefe de Juan Erviti, el consejero de sanidad de Navarra, tras la publicación del texto en el bitN -recordemos que es un resumen de otros artículos publicados en revistas internacionales muy respetadas- recibió una carta de los presidentes de cinco sociedades científicas: Cardiología, Medicina interna, Neurología, Trombosis y Hematología y Farmacología Clínica (ver comentario de NoGracias)
En esa lamentable misiva -que quedará como ejemplo de infamia científica- estos ilustres colegas disculpaban a la FDA porque «ningún procedimiento de evaluación es infalible» y a los promotores e investigadores de los ensayos clínicos bajo sospecha ya que hay que hacerse cargo de «la complejidad que entraña el diseño, la planificación y la ejecución de estudios clínicos de cierta magnitud”.
Las acusaciones contra Erviti fueron de trazo grueso: «selección bibliográfica indiscutiblemente sesgada», «actitud inaceptable para un profesional», «deslealtad», «abuso de posición» y «falta de transparencia».
Suponemos que ahora estos insignes líderes remitirán una misiva semejante al NEJM, a Bristol-Mayers-Squibb y a Pfizer porque ¿qué se puede decir a los promotores, investigadores y editores de revistas donde se publicó un ensayo clínico con datos falsificados que si se excluyese, como exigen las normas mínimas de integridad científica, de los meta-análisis posteriores, obligaría a cambiar las Guías de Práctica clínica que elaboran su sociedades científicas y que no dudan ni de su eficacia ni de su seguridad?
No doy crédito que pudieran haberse falseado resultados de estudios con Apixaban!! Necesitamos una respuesta urgente del @NEJM y de @pfizer !! https://t.co/YGqDbydWr9 @secardiologia
— José R. Juanatey (@JoseJuanatey) May 3, 2019
El Dr. José R. Juanatey, Jefe Servicio Cardiología del Hospital Clínico Universitario de Santiago de Compostela solicitaba en su cuenta personal de twitter una respuesta urgente del New England, de Pfizer y de la Sociedad Española de Cardiología. Las respuestas a este tuit del Dr. Juanatey, que divulga la research letter, son de indignación:



Esperando, esperando estamos a la respuesta de las sociedades científicas preocupadas por «que las decisiones terapéuticas están basadas en datos científicos» y en «recuperar una política de medicamentos que vuelva a tener credibilidad«
Por cierto, Juan Erviti en su respuesta a esta lamentable carta recordó que ni él ni bitN han recibido ni un solo euro de los laboratorios que comercializan los nuevos anticoagulantes pero que las sociedades científicas firmantes de la vergonzosa misiva habían recibido, solo en 2015, 991.256 euros.





Urge una respuesta científica por nuestros pacientes que se encuentran utilizando estos anticoagulantes.
Saludos .tengo a mi madre tomando apixaban alrededor de 3 años por problemas cardíacos además está con maecapaso. Cuál es el riesgo que pueda existir. Gracias
Ictus por Fa, ablación con técnica de Maze, tratamiento con ribaroxaban durante años, evolución satisfactoria
El hallazgo de irregularidades y falseamiento alguno de los miles de datos que se ingresan desde un centro de investigación no cambia la disminución de eventos y la facilidad de uso de los nuevos anticoagulantes.
En eso debemos confiar
Trabajé en uno de los centros que hizo parte del estudio ARISTOTLES, así como ROCKET AF y Otros más que hicieron parte de la aprobación de 3 de las 4 moléculas, además posterior a eso mi padre uso Xarelto por FA. Puedo decir que aunque existan centros con falsedad de datos esto no es una práctica generalizada. Ninguna de las moléculas es superior a warfarina pero tampoco fueron inferiores. Las agencias reguladoras Jan negado el uso de nueva indicación a varias de las moléculas por estudios no concluyentes. Pero la efectividad de las moléculas no se puede poner en duda por tener trabajos muy serios de muchos investigadores que lo respaldan, de no ser así y no creer en el trabajo que se hizo no habría dado a mí padre una de estas moleculas
La reputación es un valor frágil y la industria no está jugando precisamente con inteligencia sus cartas. Los medicamentos son como activos del mercado: dependen más de la confianza que de su valor objetivo. La soberbia terminó con Lehmann.
El NEJM no sólo no retracta el artículo, sino que lo incluye entre los 12 artículos más influyentes sobre la práctica clínica publicados en dicha revista en los últimos 20 años.
https://cdn.nejm.org/pdf/Drazens-Dozen.pdf
Probablemente tras el vencimiento de la patente y popularización de su precio se aclare tan opaca investigacion.