Ando inquieto últimamente sobre cómo podría la medicina mejorar sus actuaciones, que es cómo pensar en cómo podemos generar conocimiento sólido que consiga ayudar a las personas y poblaciones con mejores tratamientos, test diagnósticos e intervenciones preventivas. Hay, en este sentido, dos retos fundamentales: tener las mejores evidencias (que las pruebas sean fiables) y ser capaces de adaptarlas a los pacientes individuales y poblaciones particulares (extrapolarlas) para que puedan beneficiarlos (que las pruebas sean relevantes).
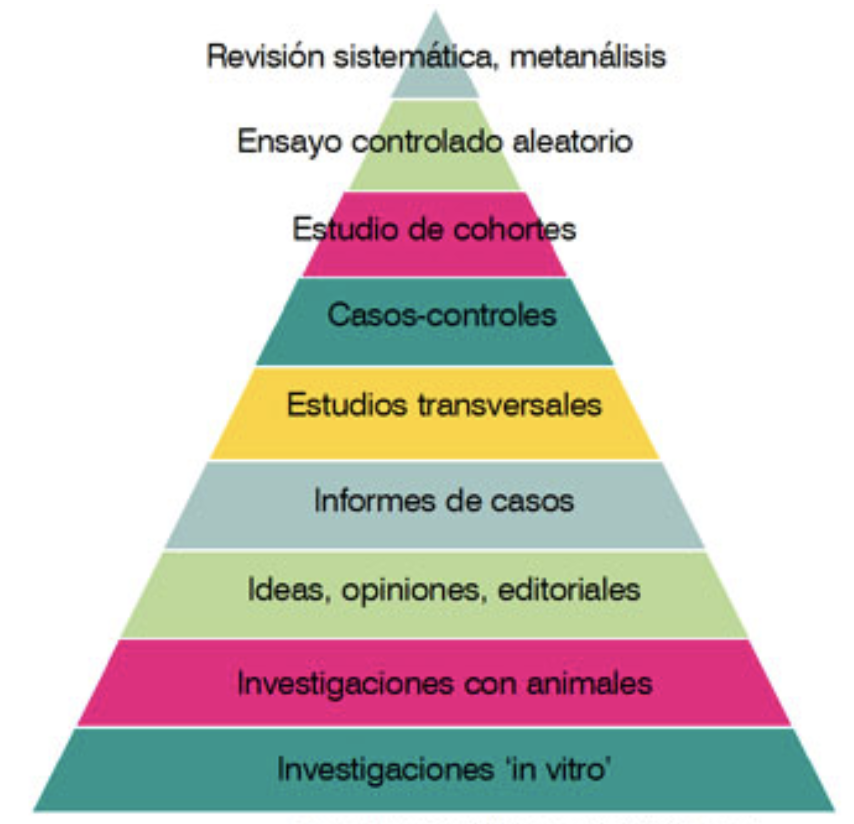
Los problemas con la fiabilidad
Las llamadas hoy en día “evidencias” anteriormente eran llamadas “razones para creer” y siempre han contado en las decisiones médicas. Lo que es nuevo quizás es el énfasis que la MBE ha tenido en categorizar las pruebas colocando en el ápice, sin ningún matiz, los ensayos clínicos por encima de los estudios observacionales, las opiniones de expertos y la investigación básica que demostraba mecanismos causales.
Ciertamente el movimiento MBE se ha centrado fundamentalmente en la fiabilidad de las pruebas y menos en su relevancia. Inicialmente se pensó que asegurando la fiabilidad se aseguraba casi automáticamente la relevancia. Y en muchos casos es así; de hecho, la fiabilidad del ensayo clínico podría ser suficiente garantía en los tratamientos agudos donde la relación temporal entre la intervención y su efecto es casi inmediata (antibióticos, fibrinolíticos, analgésicos, intervenciones quirúrgicas, insulina, anestésicos, tranquilizantes, etc..). Un caso típico que demostró la superioridad del ensayo clínico sobre el razonamiento causal fue la utilización de antiarrítmicos preventivos en la fase aguda tras un infarto de miocardio, que se generalizó en los años 80 bajo premisas mecanicistas con la lógica siguiente: si las arritmias precoces tras el infarto de miocardio son la principal causa de muerte, la utilización de antiarrítmicos reducirá la mortalidad.
Como sabemos, los ensayos clínicos realizados demostraron que la utilización preventiva de antiarrítmicos estaba incrementando la mortalidad sin que los expertos se estuvieran dando cuenta (se suele decir que los antiarrítmicos causaron más muertes en los EE.UU que la guerra de Vietnam). En este caso, tener pruebas fiables de la no eficacia de los antiarrítmicos permitió tomar decisiones relevantes con los enfermos: no hay que usarlos. Por tanto, considerar que la fiabilidad de una prueba es suficiente para tomar decisiones relevantes (que es lo que tácitamente fue asumido en los primeros años de la MBE) puede ser defendido con más o menos seguridad en los tratamientos agudos donde la relación temporal entre la intervención y su efecto es corta.
Sin embargo, la mayoría de los tratamientos e intervenciones no tienen una relación temporal inmediata sino mediata. Por ejemplo, todas las terapias o atenciones preventivas (antidiabéticos orales, hipolipemiantes, antiagregantes, anticoagulantes, antiosteoporóticos, mamografías de cribado, PSAs, antihipertensivos), la mayoría de los tratamientos para las enfermedades mentales y del comportamiento (desde la depresión al TDAH pasando por la demencia) y muchos para enfermedades como el cáncer, las patologías pulmonares, neurológicas o cardiacas, obtienen resultados en el medio-largo plazo. En este caso los ensayos clínicos también han demostrado sin lugar a dudas su especial relevancia y su superioridad sobre otras formas de obtener conocimiento cuando son negativos. Por recurrir a otro ejemplo clásico, los sesgos en grandes estudios observacionales que ocasionaron que durante años se pensara que la terapia hormonal sustitutiva era beneficiosa para las mujeres postmenopaúsicas han causado miles de muertes. No fue hasta que se realizó un ensayo clínico capaz de eliminar los sesgos de (auto)selección y de desarrollo (que incluye los sesgos de asignación y seguimiento) existentes en los estudios observacionales que pudimos saber la nefasta realidad: la terapia hormonal no solo no mejoraba la salud de las mujeres postmenopaúsicas sino que la empeoraba (más infartos, más demencia, más cáncer de mama).

https://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0010068&type=printable
Los ensayos clínicos negativos, es decir, que demuestran que una intervención no es eficaz o que sus riesgos superan los beneficios, suelen ser siempre relevantes para los enfermos; dicho de otra forma, son casi siempre extrapolables a los pacientes individuales y las poblaciones. Por eso el sesgo de publicación (la comunicación solo de los experimentos con resultados positivos) es tan dañino en términos epistémicos: le resta relevancia globalmente al conocimiento médico.

Tomado de https://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0010068&type=printable
De hecho, Archibal Cochrane –alarmado por la inflación de nuevos tratamientos que la especialización de la medicina junto con los intereses comerciales estaba trayendo a la clínica- pretendía generalizar el uso de ensayos clínicos no tanto como prueba de la eficacia de las terapias sino de su inutilidad. Sin embargo todos los cambios metodológicos de los últimos 30 años han ido en el sentido contrario: facilitar que los ensayos clínicos puedan demostrar eficacia y, por tanto, son cambios que, a la postre, le han restado fiabilidad. Centrarse en las variables subrogadas, alterar el tamaño de la muestra o el tiempo de seguimiento según interese o establecer instrumentos de medida de resultados (calidad de vida, estado de ánimo, dolor..) poco capaces de discriminar objetivos significativos clínicamente, son ejemplos de estrategias que buscan facilitar que los ensayos clínicos muestren resultados positivos.

https://www.elsevier.es/es-revista-medicina-clinica-2-linkresolver-fiabilidad-los-ensayos-clinicos-el-S0025775316305000
En general, estas estrategias metodológicas, que se han ido imponiendo en las últimas décadas (muchas de las cuales tienen importancia regulatoria y han sido descritas por Erviti y sus colaboradores en este texto), están consiguiendo debilitar enormemente la fiabilidad de los ensayos clínicos.
Esta «fiebre del experimento positivo» en la investigación biomédica tiene dos razones fundamentales y una razón facilitadora. Las dos fundamentales serían:
(1) los incentivos de los investigadores que necesitan publicar para poder progresar en sus carreras académicas y, debido al conocido sesgo en las revistas científicas que tienden a publicar con más frecuencia experimentos con resultados positivos que negativos, finalmente, consciente o inconscientemente, tienden a producir experimentos con resultados positivos;
(2) los intereses económicos de los laboratorios que son los principales financiadores de ensayos clínicos y que obviamente desean que sus productos obtengan buenos resultados en los experimentos. Es importante señalar aquí que no es necesario que haya fraude científico para obtener una desproporcionada tasa de experimentos positivos en medicina (aunque el fraude también sea lamentablemente muy prevalente).

La razón facilitadora tiene que ver con los gigantescos conflictos de interés que un área comercial en expansión genera en las organizaciones (como las sociedades científicas) e instituciones (como las agencias reguladoras, las entidades de investigación -como las universidades- o de difusión del conocimiento, como las revistas científicas) que deberían velar por controlar la “fiebre del experimento positivo” y que, al contrario, lo facilitan dando validez y crédito a una ciencia cada vez mas instrumentalizada. Este contexto comercial que domina la producción del conocimiento biomédico hoy en día no es coyuntural sino estructural y ha sido denominado tecnociencia. Sus bases político-económicas las hemos analizado en otras entradas.
Jacob Stegenga ha descrito bien como esta situación “pro experimentos positivos” es posible, sin necesidad de llegar al fraude, gracias a la capacidad de maleabilidad de los ensayos clínicos y de sus herramientas de síntesis como son los meta-análisis. Para este autor, la búsqueda del experimento positivo (por razones personales o comerciales) puede realizarse fácilmente gracias a la maleabilidad de la metodología científica y, hoy en día, su prevalencia es tan significativa que se ha generado una situación que denomina “nihilismo médico” y que define de la siguiente manera: independientemente de que una terapia tenga ensayos clínicos detrás que demuestren su eficacia, es muy probable que esa terapia sea inútil o, incluso, dañina para los pacientes.
Por tanto, yo diría que tenemos un problema grande con la fiabilidad de los ensayos clínicos debido fundamentalmente al contexto tecnocientífico en el que se genera la investigación donde todos los agentes tienen grandes incentivos (políticos, económicos, académicos, profesionales..) para utilizar la maleabilidad del método a su favor, es decir, para obtener de manera desproporcionada resultados positivos en los experimentos que validan los productos (tecnologías, medicamentos, alimentos o bebidas con propiedades saludables, etc..) que les proporcionarán a los distintos implicados ingresos a través de su comercialización (industria), el dominio político a través de la influencia comercial mundial y progreso económico a través de la creación de tejido empresarial (estado), poder y retornos económicos a través de la alianza con la industria (profesionales) o avanzar en la carrera académica y financiación (investigadores y organismos de investigación).

Los problemas con la relevancia
Pero hagamos ahora el siguiente experimento mental. Imaginemos un mundo ideal en el que la comunidad científica, médica y política se sacuda los enormes intereses que la dominan e imponga a las empresas farmacéuticas, investigadores, revistas científicas etc.. estándares de calidad, independencia y transparencia que nos permitan tener “las mejores evidencias”. ¿Podríamos entonces asumir que un experimento fiable es suficiente para considerarlo relevante? Para expresarlo en términos de Cartwright y Hardie (hablamos de su trabajo en la entrada anterior) ¿Podríamos decir que una intervención que funciona en algún sitio (la muestra experimental) o que me funciona (mi caso particular), funcionará en cualquiera (los pacientes reales)?
Teníamos claro que el razonamiento deductivo que permitía el salto del “a mi me ha funcionado” al “a este paciente le funcionará” era fuente de sesgo. Lo que no teníamos tan claro es que el salto desde “a esta muestra le ha funcionado” también puede serlo. Y es que, efectivamente, con las mejores evidencias posibles seguiríamos teniendo un enorme problemas epistemológico: el de la extrapolación. Este problema ya lo comentamos hace poco a propósito de la obra de Cartwright y Hardie “Evidence-Based Policy: A Practical Guide to Do It Better” donde se señala que un ensayo clínico positivo es un buen comienzo para asumir que una intervención pueda ser útil para “mi” paciente o población pero se va a requerir un importante proceso intelectual -fundamentado en lo que los autores llaman “investigación horizontal” (que identifique si se comparten otras variables implicadas además de la intervención) e “investigación vertical” (que identifique si se comparten relaciones últimas de causalidad)- para poder decidir responsablemente. Es decir, para estos autores, entre los que podemos incluir a Stegenga, no sería posible seguir con la idea de que los ensayos clínicos positivos son evidencias suficientes para justificar la existencia de una relación causal entre una intervención médica y su efecto en contextos diferentes al de investigación. Esta perspectiva, que exige mayores garantías epistémicas a las pruebas científicas para que sean relevantes, se denomina en filosofía de la ciencia “pluralismo evidencial”.

Este proceso de investigación vertical y horizontal que proponen y sistematizan Cartwright y Hardie desde luego complejiza enormemente los procesos de toma de decisiones. El profesor David Teira, filósofo de la ciencia de la UNED, de hecho, en un amable correo personal, me muestra sus reticencias a la factibilidad de las propuestas de Cartwright y Hardie. Me aporta el profesor Teira, además de su reflexión, este muy interesante texto donde, junto con Mattia Andreoletti, crítica las posibles ventajas, específicamente en relación con la regulación de los medicamentos, del enfoque que denomina “basado en estándares”, que asimila a la propuesta de Cartwright y Hardie, respecto al actual que denomina “basado en reglas” y que, como sabemos, utiliza como base el resultado de los ensayos clínicos (aunque sin renunciar a los estándares, al permitir también la evaluación por parte de grupos de expertos). Para el profesor Teira, el enfoque basado en estándares -que utilizaría todas las metodologías posibles para obtener conocimiento sólido, incluyendo la deliberación- es poco recomendable en los proceso de regulación. Como escribe en el artículo:
“Por ejemplo, de todas las posibles pruebas para determinar el efecto de un tratamiento que un regulador podría elegir, ¿Cuál debería el legislador escoger para promulgar las leyes pertinentes? ¿Cómo podría averiguarlo? Los estándares suelen ser más fáciles de promulgar ya que tienen un menor grado de especificidad: por ejemplo, «se prohíben tratamientos nocivos en los mercados farmacéuticos». Sin embargo, los estándares también son más costosos de hacer cumplir ya que el árbitro debe establecer en cada caso cómo aplicarlos. Por ejemplo, los reguladores farmacéuticos tendrían que decidir para cada nuevo tratamiento sobre qué base deciden evaluar los daños potenciales de los medicamentos”.
No solo sería el enfoque basado en estándares más costoso de implementar sino, también, más difícil de interpretar para todos los agentes implicados como, por ejemplo, la industria o los propios ciudadanos:
“También hay costos del enfoque basado en estándares para las otras partes interesadas. La industria farmacéutica, por ejemplo, debería decidir en qué tratamientos invertir de acuerdo con la previsibilidad de la aprobación regulatoria. Y las reglas son típicamente más predecibles que los estándares. De igual modo, en caso de que haya un posible error de regulación (por ejemplo, un tratamiento acaba siendo perjudicial), si los pacientes tienen que litigar, es más fácil discutir sobre la aplicación defectuosa de una regla que de un estándar”
En mi opinión tienen razón Mattia Andreoletti y David Teira y el enfoque basado en reglas, que utiliza predominantemente el ensayo clínico para evaluar los nuevos medicamentos en los procesos de regulación del mercado, es lo menos malo con lo que podemos contar. Aunque, desde luego, pueden mejorarse las reglas metodológicas utilizadas así como los criterios de gobernanza de todo el proceso (transparencia de los datos, rendición de cuentas, participación de otras partes..), la extrapolación no es el principal problema del legislador; más bien es la seguridad y la eficacia.

http://ebmplus.org/
Pero la toma de decisiones de los reguladores es una cosa y la toma de decisiones de los clínicos otra. ¿Es posible seguir defendiendo el monismo epistémico que coloca a los ensayos clínicos en solitario en la cúspide de las pruebas científicas que debe considerar un profesional sanitario para la toma de decisiones clínicas? Pues existe una corriente de expertos en metodología de investigación y epistemólogos que aseguran que no. Por ejemplo, en el texto que me remite el profesor Teira se cita la iniciativa EBM+ “una red de personas que buscan mejorar la forma en que la medicina basada en la evidencia introduce las evidencias de los mecanismos causales” y que han publicado recientemente, junto con otras organizaciones como CauseHealth y PhilPharm un texto en el BMJ Evidence-Based Medicina titulado “Medical scientists and philosophers worldwide appeal to EBM to expand the notion of ‘evidence’” donde se declara algo tan importante como:
“El establecimiento de la causalidad a menudo requiere el uso de múltiples métodos, ya que ninguno será universal o perfecto para este propósito. Esto significa que los enfoques estadísticos, en particular los ensayos controlados aleatorizados y las revisiones sistemáticas, al contrario de lo que se supone cuando son considerados el estándar oro, no pueden descubrir toda la información causalmente relevante.”

Accesible https://link.springer.com/book/10.1007/978-3-319-94610-8
Estos autores defienden que:
“la comprensión de los mecanismos causales puede ayudar a determinar si una intervención funciona (es decir, su eficacia demostrada en el experimento o su efectividad en la práctica clínica).”
Pero ¿basta conocer la causalidad y actuar conforme a ella para mejorar la relevancia de los tratamientos en un paradigma definido por su complejidad donde no existe nunca una única causa ni un único efecto de las intervenciones? En medicina existen escasas «balas mágicas» (en esta entrada ya comentamos este asunto), es decir, intervenciones con elevada especificidad y efectividad y que solo encintramos en enfermedades con una causalidad simple (antibióticos, algunos antivirales como los de acción directa con el virus de la hepatitis C, insulina, imatimib para la leucemia mielocítica crónica,..).
No. No es suficiente conocer, además de tener ensayos clínicos, los mecanismos causales (y, a veces, la racionalidad causal puede ser muy engañosa) Pero hay autores más exigentes epistémicamente. Mattia Andreoletti y David Teira citan el trabajo de Cartwright como el «más platónico»:
“Cartwright sugiere recopilar todos los hechos que sean relevantes para la transición de la eficacia en el ensayo a la efectividad en otras poblaciones. Para esta búsqueda, no habría ningún método algorítmico sino más bien una pluralidad de heurísticas”
Se trataría según Cartwright de buscar activamente pistas sobre la contribución de los distintos factores que podrían impedir el efecto de un tratamiento fuera del ensayo clínico. Estos procesos no pueden sintetizarse en una regla simple (y “dura”) como es un ensayo clínico positivo sino que serán enfoques evaluativos “más blandos” que requerirán, como se explica en el texto de Andreoletti y Teira, para cada caso, “deliberación sobre la evidencia que es necesaria para tomar esta decisión concreta”.
Nancy Cartwright, una de las principales filósofas de la causalidad, es una firme enemiga de la interpretación «algorítmica» de las pruebas causales en los procesos de elaboración de políticas públicas. Yo creo que su trabajo es fundamental también para las decisiones clínicas. Su enfoque deliberativo está basado en consensos que, aplicado a los escenarios clínicos, se adquirirían mediante la ponderación de las evidencias disponibles (ECAS, evidencias causales, estudios observacionales..) en foros o encuentros clínicos que incorporen la opinión de expertos (el médico es el experto más cercano al paciente y, por tanto, los aspectos relacionales son imprescindibles), los valores de los enfermos y variables contextuales (nivel socioeconómico local o del paciente, funcionamiento de los servicios sanitarios locales, etc..).
Este proceso de generación de conocimiento relevante es mucho más exigente que la simple extrapolación del ensayo clínico al que estamos acostumbrados en medicina y a cuya simplicidad tanto han contribuido las rígidas pirámides de la evidencia (es cierto, como me han señalado algunos compañeros en tuitter, que la iniciativa GRADE intenta también superar las limitaciones epistémicas de la MBE en este sentido pero desde mi punto de vista no supera la propuesta de Cartwright; hablaremos de ello en otra entrada).
Para Nancy Cartwright, vivimos en un mundo de relaciones causales “manchadas” (dappled) que no permiten garantizar a priori que una intervención médica que ha funcionado en un ensayo clínico funcione de la misma manera en una situación diferente. Las intervenciones causales nunca trabajan solas sino en combinación con otros factores y variables de apoyo que podrían o no funcionar en diferentes contextos. Asumir esta complejidad epistémica es una tarea pendiente en la medicina clínica.
¿Es más confiable el método deliberativo que el basado en reglas para evaluar relaciones de causalidad en biomedicina?
Para acabar esta entrada. ¿Es el método deliberativo de Cartwright -que establece estándares de forma consensuada y para cada caso determina las fuentes evidenciales más pertinentes- menos susceptible de estar sesgado o ser manipulado comercial o profesionalmente que el actual método basado en reglas?

http://www.center4research.org/fda-advisory-committees-approval-mean-safety/
Para Mattia Andreoletti y David Teira, en el contexto regulatorio, desde luego no parece ser así. Citan un trabajo que demuestra como los comités de expertos de la FDA -que teóricamente deberían deliberar cuando las evidencias de los ensayos clínicos son controvertidas- votan con unanimidad a favor del medicamento en el 66% de las ocasiones.

https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4221752/
Ciertamente los expertos de la FDA no son los profesionales más independientes del mundo. En esta revisión de sus decisiones entre 1997 y 2011 muestran un importante «sesgo pro-sponsor». Es muy probable que los problemas regulatorios existentes (menos centrados en la extrapolación que en la seguridad y la eficacia) tengan una solución más sencilla que confiar en los expertos: contar con mejores ensayos clínicos.

https://kiej.georgetown.edu/wordpress/wp-content/uploads/2013/12/23.4.biddle.pdf
Los autores proponen, en todo caso, una muy interesante alternativa para poder incorporar a los procesos decisionales regulatorios basados en reglas una modulación más sofisticada basada en estándares.
Pero ¿pasaría lo mismo en el contexto clínico? ¿Supondría la introducción de procesos decisionales de superior sofisticación epistémica una mayor fuente de sesgo? Ya comentamos en la entrada anterior, donde Stegenga proponía recuperar los criterios de causalidad de Bradford Hill, que asumir el pluralismo evidencial no evitaría la maleabilidad pero sería, en nuestra opinión, más confiable que el escenario actual donde todos los agentes actúan con una extremada seguridad debido a la falsa idea trasmitida por la MBE de que los ensayos clínicos son fiables y relevantes.
Si los clínicos se sacudieran esa ficción de objetividad en la que basan hoy en día sus decisiones y asumieran, por una parte, los enormes problemas de fiabilidad con las evidencias existentes en la actualidad y, por la otra, las dificultades epistémicas para la extrapolación, ya estaríamos avanzando mucho porque se impondría un juicio mucho más prudente en la prescripción en particular y en las decisiones clínicas en general.
Si además se asumiera que es necesario un pluralismo evidencial que considere todas las fuentes de conocimiento (causal, observacional, experiencial, relacional) y que ese proceso solo puede ser deliberativo y contexto dependiente, es decir, una construcción local de conocimiento, también estaríamos avanzando mucho.
Si encima reconociéramos que ese proceso de construcción local de conocimiento solo puede hacerse multidisciplinariamente y, por sus características intrínsecas, desde la atención primaria, también se avanzaría algo más (sobre todo si los políticos y gestores reconocieran la necesidad de empoderar con recursos a la atención primaria como decisora final, con todo el asesoramiento superespecializado necesario, en la utilización de la mayoría de los tratamientos, intervenciones y tecnologías).
La alternativa al pluralismo evidencial en los procesos de toma de decisiones clínicas es seguir en el actual paradigma basado en reglas y decisiones algorítmicas, algo que está dañando no solo a los enfermos (con emergentes problemas de medicalización, seguridad y polimedicación), no solo a los presupuestos (por ser incapaz de modular la utilización de las innovaciones) si no a la propia cultura médica que está dejando de confiar en procesos decisionales basados en el juicio clínico.
¿Cómo lo hacemos? Sin duda, estos procesos de construcción de conocimiento local están por desarrollar. Pero si no nos sacudimos la hegemonía del ensayo clínico no seremos capaces de pensarnos pensando de otra manera
CONCLUSIONES
- El sueño de la MBE que pretendía en sus inicios poder garantizar la relevancia del conocimiento asegurando su fiabilidad es solo eso, un sueño.
- Que el ensayo clínico no sea una garantía suficiente para la toma de decisiones clínicas no implica que no sea fundamental para las decisiones regulatorias y, en los escenarios asistenciales reales, muy relevante especialmente en la evaluación de las terapias de enfermedades agudas y cuando sus resultados sean negativos
- El problema de la «fiebre por el experimento positivo» que ha invadido la investigación biomédica y que nos ha conducido a una grave quiebra de la fiabilidad de los resultados de la experimentación clínica y a una situación de, como la llama Stegenga, nihilismo médico, requiere soluciones complejas (políticas, regulatorias, profesionales, científicas..) y es una tarea pendiente que, excepto en la necesidad de evitar los conflictos de interés de los profesionales, supera las responsabilidades individuales.
- Lo que no supera las responsabilidades individuales es la necesidad de que los profesionales sanitarios sean conscientes de las garantías extra que requiere la extrapolación de los resultados de los ensayos clínicos a los pacientes y poblaciones concretas, y del reduccionismo que la pirámide de las evidencias de la MBE ha introducido en los procesos decisionales.
- La extrapolación clínica responsable requiere incorporar, a la hora de decidir, todas las evidencias posibles (pluralismo evidencial), donde el ECA ya no tendrá la categoría reina asignada hasta el momento y deberá ser considerado en igualdad de condiciones con otras fuentes de evidencia, hasta ahora subestimadas en su importancia, que incluirán estudios de causalidad (mecanicismo), estudios observacionales, evidencias empíricas personales y procesos deliberativos amplios que incluyan, desde luego, a los pacientes y otros implicados (como los financiadores)
- El proceso de generación de conocimiento sólido en medicina no puede obviar los consensos que pensábamos estaban superados con la llegada de la MBE. Se trata de avanzar en los criterios que debemos exigir a un consenso para que sea legítimo en la clínica (desde luego lejos del antiguo criterio centrado en los expertos), y no tanto de buscar la certeza experimental o negar la complejidad porque este “mirar a otra parte” solo conduce al sesgo basado en las evidencias, el reduccionismo intelectual, la pérdida de facultades de juicio clínico de los profesionales, la infravaloración de la experiencia y el daño a los pacientes vía medicalización, polimedicación y problemas de seguridad.
Abel Novoa es médico de familia y presidente de NoGracias


Yo, como profana en medicina y en tecnicismos científicos, hago mi propuesta: hace falta también que se siga extendiendo el empoderamiento a la población de a pie. Sé que lleva su tiempo pero no está de más hacer un esfuerzo cada uno de los que sabemos ya de qué pie cojea el sistema por divulgar la verdad. Agradezco todo lo que he aprendido del Dr. Gervas y otros médicos, nutricionistas e higienistas que divulgan sus conocimientos por internet. Me siento muchísimo más sana, joven y vital, y me siento liberada.
Muchas gracias y a seguir dando luz a los demás. Entre todos: ustedes como médicos y científicos, nosotros como pueblo o gente corriente.
Este es el mismo mensaje pero corregido, ya que no pude borrarlo:
Yo, como profana en medicina y en tecnicismos científicos, hago mi propuesta: hace falta también que se siga extendiendo el empoderamiento a la población de a pie. Sé que lleva su tiempo pero no está de más hacer un esfuerzo cada uno de nosotros (los que sabemos ya de qué pie cojea el sistema) por divulgar la verdad. Agradezco todo lo que he aprendido del Dr. Gervas y otros médicos, nutricionistas e higienistas que divulgan sus conocimientos por internet. Me siento muchísimo más sana, joven y vital, y me siento liberada.